|
2500L配制罐清洁验证时间:2017-08-03 目 录
一、验证方案 二、验证记录 三、验证变更 四、验证结论及评价 五、验证报告及合格证书
方案审核:质量保证部 审核人: 日期 生产制造部 审核人: 日期 方案批准:验证办公室 批准人: 日期 实施时间: 年 月 日—— 年 月 日
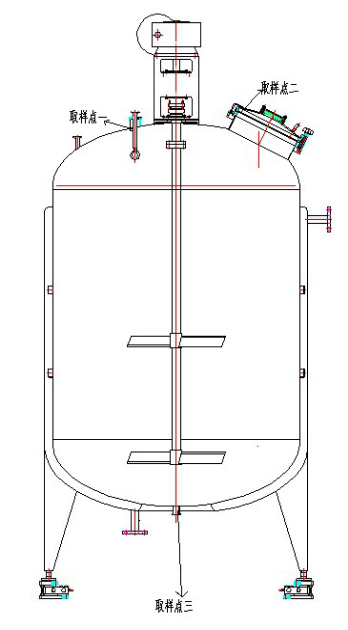
2500L配制罐清洁验证方案 1.引言 1.1概述: 设备名称:配制罐 规格: 2500L 安装位置:十万级洁净区车间配制间 设备编号:1A-134 1.2本公司配制车间新购进2500L配制罐一台,生产厂家为南京佳顿自动化设备有限公司,此配制罐内胆材质为316L不锈钢材质,内表面光滑,全容积4200L,公称容积3500L。用于口服液产品的配制,通常配制体积为3300L。 1.3本罐上部为椭圆封头,下面椭圆封头形式,圆角采用日式平板液压成形;各管口连接处均经拉延处理,保证其转角部分以R圆弧平滑过渡;罐体所有焊缝经应力消除机处理,保证内表面粗糙度Ra≤0.6μm,这样避免了产品残留,符合卫生级要求。 1.4本罐主要由罐本体及附件组成。罐本体双层结构,配有夹套,主体由支脚、封头、人孔、筒体等组成。罐附件主要包括视镜视灯、称重模块、清洗球、料液进出管、呼吸口、呼吸器和其它选项如:搅拌系统,在线清洁系统等。 1.5搅拌器为机械搅拌:搅拌电机安装在罐顶,搅拌轴由上半轴和下半轴组成,其中上半轴与罐体之间采用密封性能好、使用寿命长的204型硬质合金机械密封,下半轴通过法兰与上半轴联接,搅拌桨叶焊于下搅拌轴上。 1.6在线清洁系统CIP:配有专用压力泵和管路,与罐顶清洗球相连,保证其清洗效果可以满足生产需要。必要时还可用高压水枪进行清洁。 2清洁方法及验证。 2.1此设备清洁按《PYG-3500配液罐清洁标准操作规程》QSOP-WS-169-01(草案)执行。 2.1 清洁、消毒方法: 2.1.1 PYG-3500配液罐预处理:用2%NaOH溶液(约3500升)加入配制罐,启动用快接管连接的专用不锈钢泵从配制罐下口沿配制罐喷淋球循环3小时以上,放掉NaOH溶液。启用CIP系统使用饮用水将配制罐内壁、搅拌桨叶等冲洗至pH值中性,同样方式用纯化水冲洗10分钟。 2.1.2 连续生产: 2.1.2.1生产使用前:启用CIP系统用纯化水冲洗10分钟,要求制罐内壁、搅拌桨叶等洁净,即可使用。 2.1.2.2生产使用后:启用CIP系统用饮用水冲洗30~60分钟,要求配制罐内壁、搅拌桨叶等不得有残留药液,必要时用高压水枪冲洗。再用纯化水冲洗10分钟。 2.1.3更换品种或超过有效期清洁:启用CIP系统用纯化水将配制罐内壁、搅拌桨叶等冲洗干净,要求配制罐内壁、搅拌桨叶等不得有残留药液,必要时用高压水枪冲洗。再用2% NaOH溶液(约300升)加入配制罐,启动用快接管连接的专用不锈钢泵从配制罐下口沿配制罐喷淋球循环30分钟以上,放掉NaOH溶液,启用CIP系统用饮用水冲洗至中性,然后启用CIP系统用纯化水冲洗10分钟。 2.1.4设备维修保养后进行清洁:同2.1.3项“更换品种或超过有效期清洁”。 2.1.5 清洁效果评价:要求制罐内壁、搅拌桨叶等洁净,冲洗的纯化水pH值呈中性。 2.2验证的目的:3500L配液罐安装于十万级洁净区,为密闭系统,其主要污染风险首先来自于新设备从一般区进入洁净区带来的污染风险,在使用过程中清洁不彻底造成上批产品或清洁剂残留,以及微生物滋生。此次对3500L配液罐的清洁方法进行验证。首先对新设备进行预处理操作,清洁合格后投入使用。然后分别跟踪三批次连续生产相同品种清洁,及更换品种或超效期清洁操作。将设备按前述清洁方法进行清洁,然后取样检测。通过检验确定其清洁方法是否安全有效,能够预防药品生产中的污染及来自上批药品的交叉污染。 2.3验证产品选择:此设备主要用于茵栀黄口服液的配制,是茵陈、栀子、金银花三味中药提取物以及黄芩苷、蔗糖等原辅料最终混合均匀的容器。所以用茵栀黄口服液作为清洁验证的品种。茵栀黄口服液为棕红色液体,其主要活性成分黄芩苷,不易溶于水,相对较难清洁, 所以用检测黄芩苷残留量检查此设备是否清洁彻底。 2.4取样点的确定: 2.4.1表面取样点的选择: 此配制罐为316L不锈钢材质,内表面光滑;清洗球与罐体连接处(取样点一)、罐盖内边缘密封垫(取样点二)、出液口(取样点三)相对较难清洁,所以对此三处进行表面擦拭取样检测微生物限度。 2.4.2最终冲洗水取样: 配制罐用1%NaOH溶液清洁,所以于放料口(取样点三)处取最终冲洗水检测PH值、总有机碳(数据收集)、微生物限度并与原纯化水进行对比,另取最终冲洗水检测药物残留。根据检验结果确定其清洁是否彻底。
2.6验证可接受标准: 2.5.1表面擦拭:棉签微生物计数≤50cfu/25cm2 2.5.2最终冲洗水:pH值:符合纯化水pH值标准 微生物限度:微生物计数≤100cfu/ml 药液残留:黄芩苷<1.2×10-3g/ml (茵栀黄口服液每10毫升含黄芩苷0.4克。用法与用量为:口服,一日3次;一次10ml,日剂量为30毫升。可折算为黄芩苷1.2克。以日剂量的千分之一计算,验证合格标准为:最终清洗水中每毫升应含黄芩苷<1.2×10-3克。) 2.7参加验证人员及职责:
2.8本验证的验证周期为五年,设备或产品变更都要进行再验证。
3.验证前准备 A、按常规清洁的10ml小烧杯供pH值测定,总有机碳(数据收集)测试取样瓶供总有机碳测试用。 B、经无菌处理的100ml具塞三角瓶1个供微生物限度取样。 C、经无菌处理的试管若干,供棉签擦拭取样用。 D、无菌棉签若干。 E、100ml三角瓶2个供检测药液残留取样用。 4.验证实施 4.1验证方法: 4.1.1设备安装完成后投入生产前按《PYG-3500配液罐清洁标准操作规程》PYG-3500配液罐预处理项操作。按2.4项要求取样检验,确定设备清洁合格可以投入使用。 4.1.2生产过程中采用同步验证法于下一批生产前按“PYG-3500配液罐清洁标准操作规程”进行清洁后,目检表面洁净、无可见异物后取样检查。确定其清洁合格无污染、无上批产品残留。 4.2清洁操作: 4.2.1生产前由生产操作人员按《PYG-3500配液罐清洁标准操作规程》配液罐预处理项对设备进行清洁:用2%NaOH溶液(约3500升)加入配制罐,启动用快接管连接的专用不锈钢泵从配制罐下口沿配制罐喷淋球循环3小时以上,放掉NaOH溶液。启用CIP系统使用饮用水将配制罐内壁、搅拌桨叶等冲洗至pH值中性,同样方式用纯化水冲洗10分钟。 4.2.2连续生产相同品种时清洁: 4.2.2.1生产使用前:启用CIP系统用纯化水冲洗10分钟,要求制罐内壁、搅拌桨叶等洁净,即可使用。 4.2.2.2生产使用后:启用CIP系统用饮用水冲洗30~60分钟,要求配制罐内壁、搅拌桨叶等不得有残留药液,必要时用高压水枪冲洗。再用纯化水冲洗10分钟。 4.2.3更换品种或超过有效期清洁:启用CIP系统用纯化水将配制罐内壁、搅拌桨叶等冲洗干净,要求配制罐内壁、搅拌桨叶等不得有残留药液,必要时用高压水枪冲洗。再用2% NaOH溶液(约300升)加入配制罐,启动用快接管连接的专用不锈钢泵从配制罐下口沿配制罐喷淋球循环30分钟以上,放掉NaOH溶液,启用CIP系统用饮用水冲洗至中性,然后启用CIP系统用纯化水冲洗10分钟。 4.3取样: 4.3.1设备安装完成后投入生产前按《PYG-3500配液罐清洁标准操作规程》配液罐预处理清洁。于取样点一、取样点二、取样点三擦拭取样,测微生物限度。于取样点三处取最终冲洗水,测微生物、pH值、总有机碳(数据收集)。取原纯化水测微生物、pH值、总有机碳做空白对照。 4.3.2连续生产相同品种时:配制罐清洁操作结束,取样员首先目检所取设备洁净、无可见残留物,于取样点一、取样点二、取样点三擦拭取样,测微生物限度。于取样点三处取最终冲洗水,测药物主要成分黄芩苷残留量、微生物、pH值、总有机碳(数据收集)。取原纯化水测微生物、pH值、总有机碳做空白对照。 4.3.3更换品种或超过有效期时:配制罐清洁操作结束,取样员首先目检所取设备洁净、无可见残留物,于取样点一、取样点二、取样点三擦拭取样,测微生物限度。于取样点三处取最终冲洗水,测药物主要成分黄芩苷残留量、微生物、pH值、总有机碳(数据收集)。取原纯化水测微生物、pH值、总有机碳(数据收集)做空白对照。 4.3.4该验证连续重复做三批次。每次清洁后,检查清洁效果,检测PH值,微生物限度及上批配制药物残留。 5再验证:系统发生变更需进行再验证,如果没有变更每五年进行再验证。
1计量器具检查
检查人: 复核人: 日期: 2验证所需的文件检查
检查人: 复核人: 日期:
3. 对涉及本验证的相关人员培训记录 主讲人:
受培训人员:
培训日期:
4 取样检验记录 (1).配制罐安装后生产前进行预处理清洁取样汇总 擦拭样检验结果:
汇总人: 复核人: 日期:
最终冲洗水原水:
汇总人: 复核人: 日期:
表面擦拭取样微生物检验结果汇总
汇总人: 复核人: 日期:
配制罐最终冲洗水检验结果汇总
汇总人: 复核人: 日期:
表面擦拭取样微生物检验结果汇总
汇总人: 复核人: 日期:
配制罐最终冲洗水检验结果汇总
汇总人: 复核人: 日期:
项目:
结论:
复核人: 日期: 批准人: 日期:
验证小组: 日 期:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||