浅谈配液系统软件对法规符合性的理解
自从2010版GMP的发布开始,到后面的新疫苗法的实施,对于制药行业的要求越来越严格,计算机化系统附录中6章24条涵盖了对计算机化系统的验证、管理、风险控制、权限、系统生命周期、数据审计追踪、数据完整性等多方面,如何满足GMP提出的要求是每个制药企业不得不面临的问题。本文主要简述每个地区的法规指南和GAMP 5 的简要介绍以及相关的数据或者报表的要求。
目前药品的法律和法规主要有FDA、GAMP5和GMP等等。GAMP5是国际制药工程协会(ISPE)从确保计算机化系统既能满足预定用途又能符合GMP法规要求出发,组织专家编写的一套简称为GAMP的方法指南文件,由于ISPE所制订的GAMP和GMP不一样,它不属于强制性的规范和标准,而是一个理论和实践方法上的指南。因为它不属于规范,ISPE也不属于认证机构,所以在GAMP中也声明:任何宣称“已通过GAMP认证”或者“已获得GAMP批准”是不合适的。
但是虽然它不属于法规,却是目前国际制药行业进行计算机化系统验证方法的主要参考依据,同时也是医药自动化最重要的合规性指南。
各个国家和地区的法规,指南和建议配置时必须遵守国际主管部门和组织需要在GMP环境中进行验证的计算机系统。关于在计算机系统中,以下内容特别重要:
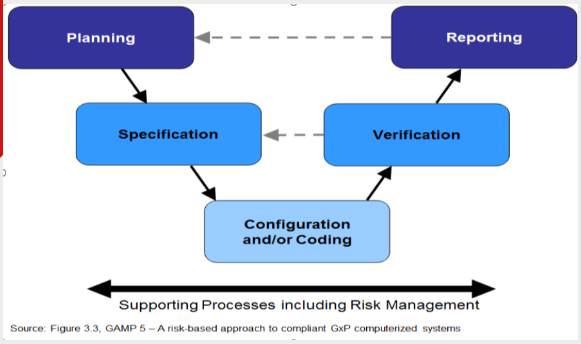
下图显示了GAMP5用于开发GAMP5的一般方法电脑系统。它从项目的规划阶段开始,到结束完成测试和报告后,开始生产药品。
关于电子记录要求(Requirementsfor electronic records)
以下附加要求适用于将电子记录用于相关数据:
•系统必须经过验证
•只有授权人员才能输入或更改数据(访问控制)
•必须记录对数据的更改或删除(审核记录)
•必须存储与长期归档有关的电子记录安全并在保留期内可用
•法规要求的缩写和签名必须按照电子签名
•“相关”生产步骤/过程,“重要”过渡阶段和“主要”设备必须由负责人事先定义。
•欧盟GMP准则第4.9章和附件11
•美国FDA21 CFR Part 11“电子记录,电子签名”
配液系统电子记录包括传感器记录、电子签名记录、审计追踪记录、系统事件等等,可以按照时间范围或者是批次或者是数据类型查询
关于电子签名(Electronicsignatures)
电子签名是计算机生成的信息,具有法律效力等同于手写签名的绑定。
例如,定义了有关使用电子签名的法规,美国FDA的21CFR第11部分或《欧盟GMP指南》附件11中的内容。
电子签名在实践中是相关的,例如对于手动数据输入运行期间的操作员干预,过程动作和数据的批准报告和配方更改。
配液系统电子签名通过使用电子签名可以使关键操作的执行取决于用户的电子签名。只有当已组态用户通过密码验证后,才能执行给定的操作。如果用户未经授权或输入错误密码,则不能执行该操作,在每个关键动作执行之前都需要有相应权限的人才能操作。
关于批次报告数据(Reportingbatch data)
批处理文件在药品和医疗设备的生产中特别重要。对于制药商,正确创建的批处理文档通常代表唯一的文档产品责任范围内的证据。
批处理文档的组件如下:
•主生产记录和批量生产记录
•包装说明和包装记录(成品包装从制药的角度来看,药物是制造过程的一部分)
•测试说明和测试报告(用于所有质量检查,例如,化学分析)
批生产记录的概念被赋予了中心重要性,或者包装记录,定义如下:
•批次生产记录始终与产品和批次相关
•始终基于适用的主生产的相应部分记录
配液系统批次报表内容
•批次和关键工艺节点的开始时间和结束时间
•当前批次过程的报警记录
•当前批次过程的审计追踪记录
•当前批次过程的关键数据记录和曲线
•当前批次过程的运行记录
关于审计追踪(Audittrail)
审计追踪是系统的控制机制,允许输入所有数据或修改以追溯到原始数据。安全的审计追踪尤其重要当创建、修改或删除与GMP相关的电子记录时,这一点很重要。
此类审计追踪必须记录所有与公司一起做出的更改或采取的措施的日期和时间。审核跟踪的典型内容描述了谁更改了哪些内容(旧值/新值)时,还可以包含“为什么修改”作为选项。
配液系统审计追踪内容
•账户登录与退出
•系统事件
•操作者操作记录
•工艺参数修改记录
•阀门动作记录
结语
近阶段的药品记录与数据管理要求自2020年12月1日施行,对于纸质记录、电子记录、数据管理等都做了详细的阐述。要求规定电子数据必须保证数据真实、准确、完成和可追溯,配液系统所有数据都来自原始数据库,在批次报表中电子数据记录、审计追溯、系统日志、电子签名等等都有记录。
推荐
-

QQ空间
-

新浪微博
-

人人网
-

豆瓣


